|
Električni dipol.
Razumemo ga kot par točkastih nabojev Q in
-Q, ki sta si zelo
blizu, na oddaljenosti d (slika 1).
Primer! Iz kemije
poznamo polarne molekule.
Značilen predstavnik je molekula vode, v kateri je par vodikovih
atomov povezan v atom kisika s kovalentno vezjo. Nje atomi
leže v ogljiščih enakokrakega trikotnika tako, da oklepata kraka O-H
kot 104 ° (slika 2).
Atoma vodika težita
sprejeti elektrona, kisikov pa dva manjkajoča elektrona. Moč
slednjega je večja, zato pritegne vodikova elektrona bolj k sebi.
Težišče negativnih nabojev molekule se prevesi na stran kisika,
težišče pozitivnih pa na stran vodikov. Naboje molekule vode moremo
torej modelirati z dipolom. Polarno molekulo imenujemo stalni
oziroma permanentni dipol; more pa kak delec imeti dipolski
značaj še iz drugačnega razloga, vendar o tem še kasneje.
Dipol in
električno polje. Dipol naj se nahaja v električnem polju.
Naboja ±Q (Q
> 0), ki sta vsaksebi na
neznatni oddaljenosti d, se znajdeta v lokalno
homogenem polju, ki ima na primer tam jakost E. Na njiju
delujeta nasprotni električni sili Fe
= QE
= F in
-F oziroma
dvojica sil (slika 3).
Par sil teži naboja
premakniti; vsakega v svojo smer. Pri oddaljenosti d med
nabojema sta projekciji ±Fd
sil brez pravega učinka, medtem ko zmoreta projekciji
±Fn sil
dipol zavrteti okoli osi tako, da se naboj Q pomakne v smer
polja E, naboj -Q
pa v nasprotno smer. Za učinkovit zasuk dipola je očitno pomemben
kót med distančnim vektorjem d in vektorjem sile F, ki
določa iznosa za vrtenje koristnih projekcij
±Fn. Da
bi mogli ovrednotiti jakost zasuka, moramo nekaj pozornosti nameniti
navoru, ki je še toliko bolj aktualen v fiziki in mehaniki:
pri delovanju sile na ročici.
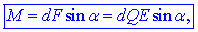
Dipolska
polarizacija. Brž ko je v električnem polju snov, ki jo
napolnjuje gosta množica polarnih molekul, kot so to voda, alkohol
in še nekatere druge snovi, prihaja zaradi navorov na molekule do
njihovega obračanja. Up, da se bodo kar vse in v celoti obrnile v
smer polja, ni osnovan. Zakaj? Molekule so v takih snoveh podvržene
tudi termičnemu gibanju (naključnemu obračanju), zato se v
električnem polju orientirajo ene bolj, druge pač manj. Usmerjenost
molekul oziroma stopnjo polarizacije snovi je treba razumeti v
poprečnem ali makroskopskem v smislu. Je pa gotovo res, da bo pri
večji poljski jakosti ta stopnja orientiranosti večja (slika 7).
Kaj ko bi takšne
molekule izpostavili harmonični poljski jakosti? Molekule bi se
obračale; ravnale bi se po trenutni orientaciji polja.
|