|
||||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
7.1.1 FARADAYEV ZAKON ELEKTROLIZE |
|||||||||||||||||||||||||||||
|
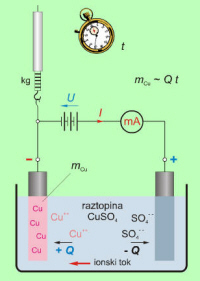
Ioni elektrolita s svojo elektrino omogočajo tok v električnem tokokrogu, po pristanku na elektrodi pa povečajo maso elektrode (sl. 7.1.1.1). |
|
|||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
Ioni raznih raztopin se razlikujejo po elektrini in masi, zato bo z enako, na elektrodo preneseno elektrino iz elektrolita izločena različna masa različnih snovi. Mase različnih snovi, ki jih izloči elektrina 1 C, so izmerjene in zbrane v fizikalnih in kemijskih priročnikih. Imenujemo jih elektrokemijski ekvivalenti, označujemo s c in merimo v kg/C (preglednica 7.1.1.1). |
||||||||||||||||||||||||||||||
|
Preglednica 7.1.1.1: Elektrokemijski ekvivalenti |
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
Če upoštevamo, da je pri elektrolizi s konstantnim enosmernim električnim tokom z izločeno snovjo na elektrodo prenesena elektrina Q = I · t, lahko sklenemo: |
||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||
|
Ugotovljena odvisnost iz elektrolita izločene snovi je temeljni zakon elektrolize in ga po njegovem utemeljitelju imenujemo Faradayev zakon1 elektrolize. |
||||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||
|
|
|
|||||||||||||||||||||||||||||
|
1 angleški fizik, 1791−1867 |
||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||
|
|