|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
7.1 ELEKTROLIZA |
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
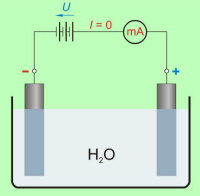
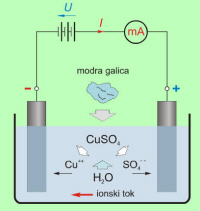
Kemijsko čista voda nima prosto gibljivih naelektrenih delcev, električno nevtralne molekule soli (NaCl, CuSO4 … ) in kislin (H2SO4, HCl … ) pa v vodi razpadejo na ione (sl. 7.1.2), ki omogočajo električni tok skozi raztopino. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Razpadu električno nevtralnih molekul v vodi na ione pravimo elektrolitska disociacija1 , nastali raztopini pa elektrolit. Elektrolit je, čeprav poln ionov, kot celota navzven električno nevtralen. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Pozitivni (Cu++, sl. 7.1.2) ioni potujejo proti negativni elektrodi (katodi), negativni ioni (npr. SO4- -) pa proti pozitivni elektrodi (anodi). |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Na elektrodah ioni pridobijo manjkajoče elektrone ali oddajo presežek elektronov in se nevtralizirajo. Iz elektrolita izločeni ioni najpogosteje, brez reakcije z elektrodo ali vodo, obstanejo na elektrodi ali pa jo zapustijo v obliki plina ali usedline. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
7.1.1 FARADAYEV ZAKON
ELEKTROLIZE 7.1.2 TEHNIČNA UPORABA ELEKTROLIZE |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 dissociatio, lat. = razdružitev, razkroj, razpad 2 elektro + lysis, gr. = razkrajanje z električnim tokom |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|